La salinità e la densità dell’acqua in un acquario marino di barriera

Introduzione
L’acqua marina è una soluzione particolarmente complessa costituita, in forma più o meno concentrata, da tutti gli elementi presenti nella nostra Terra che contribuiscono a determinarne il contenuto salino. L’acqua salata costituisce il 97% circa dell’idrosfera e ricopre il 69% circa della Terra. Quando parliamo di acque di mareIl mare è una vasta distesa di acqua salata, idrograficamente connessa con un oceano, che lambisce le coste di isole e terre continentali. Lo stesso termine certe volte è usato per indicare laghi, normalmente salati o molto voluminosi, che non hanno sbocchi sull'oceano come ad esempio il Mar Caspio, il Mar Morto ed il Mar di Galilea. Il termine mare è usato anche come sinonimo di oceano quando esprime un concetto generico, per esempio quando si parla dei mari tropicali o dell'acqua marina riferendosi, invece, a quella oceanica in generale. Leggi ci riferiamo a quelle dell’oceanoCol termine oceano si intendono le più vaste distese d'acqua salata presenti sulla superficie terrestre. Si distinguono dai mari per le dimensioni; i mari sono infatti insenature marginali degli oceani, e sono generalmente diversi per caratteristiche geologiche dei fondali. Secondo la definizione del 1953 dell'Ufficio idrografico internazionale, vi è un unico oceano diviso in quattro bacini:
• Oceano Pacifico, 179 000 000 km²
• Oceano Atlantico, 106 000 000 km²
• Oceano Indiano, 73 550 000 km²
• Oceano Artico, 14 060 000 km²
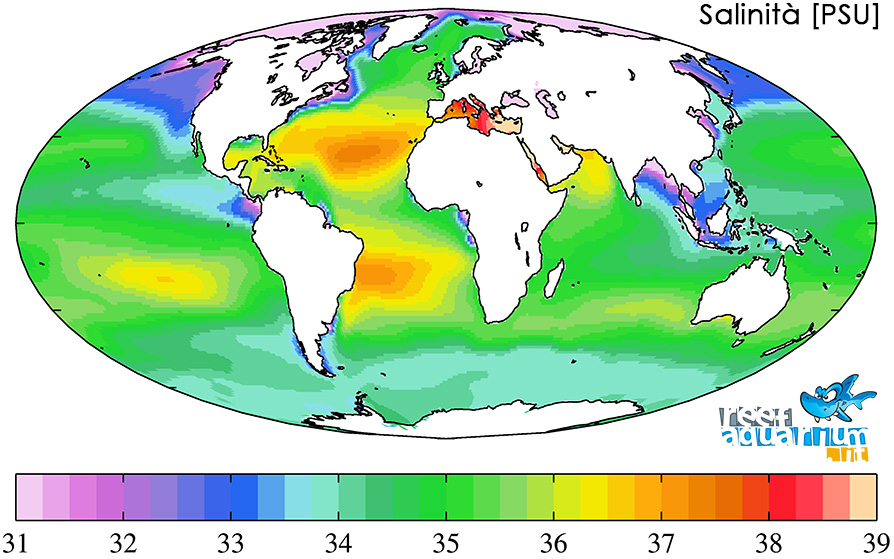
Leggi (mari eualini) dove la salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi si attesta mediamente intorno al 35 ‰ (35 grammi di saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi ogni 1000 grammi di soluzione ), benché questo sia un parametro estremamente variabile, oscillando in funzione di particolari condizioni naturali e ambientali tra il 28 e il 40 ‰. Si consideri che mentre nei Caraibi è possibile rilevare una concentrazione media prossima al 35-36 ‰, nel Mar Rosso il contenuto di saleIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi risulta sensibilmente più elevato (40 ‰).
Questo notevole range di differenze rispecchia la complessità delle correlazioni esistenti tra numerosi fattori come le precipitazioni, l’evaporazione, l’afflusso di acqua dolce e le correnti marine, e in funzione di questo è possibile classificare:
- I mari salmastri con salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi che ricade all’interno dell’intervallo del 0,5 – 29‰;
- I mari eualini con salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi che ricade all’interno dell’intervallo del 30 – 35 ‰
- I mari metaalini con salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi che ricade all’interno dell’intervallo del 36 – 40‰.
La salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi è un fattore ecologico di considerevole importanza, in grado di influenzare la tipologia di organismi che vivono in un corpo idrico e influenza le specie di piante in grado di crescere in un ambiente acquatico o in un terreno lambito dall’acqua.
La salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi indica dunque la concentrazione di saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi di una soluzione. Se in passato essa veniva determinata sulla base della clorinitàLa clorinità è una grandezza che esprime il contenuto totale degli alogenuri cloruro (Cl-), bromuro (Br-) e ioduro (I-) all'interno di un corpo idrico. Leggi, (grandezza che esprime il contenuto totale di cloruriLo ione cloruro (formula chimica Cl−) è lo ione di cloro con numero di ossidazione −1, cioè un atomo di cloro carico negativamente con un elettrone. Esso si forma normalmente sciogliendo acido cloridrico in acqua. I sali che contengono uno ione di questo tipo vengono detti cloruri. Ha una massa molecolare pari a circa 35,453 u ed è registrato col numero CAS 16887-00-6[4]. Leggi (Cl-), bromuriUn bromuro è un anione del bromo, che possiede quest'ultimo con stato di ossidazione −1. I sali contenenti questo ione sono detti bromuri. Un indicatore per i bromuri è l'aggiunta di acido nitrico e nitrato di argento: se lo ione è presente, si formerà un denso precipitato, che scomparirà con l'aggiunta di ammoniaca concentrata. Lo ione bromuro è presente tipicamente nell'acqua marina con una concentrazione di circa 65 mg/L, che è lo 0,2% di tutti i sali dissolti. Leggi (Br-) e ioduriCon il termine ioduri si indicano genericamente i sali dello iodio, come ad esempio lo ioduro di potassio (largamente impiegato in farmacologia) e lo ioduro d'argento (componente fondamentale delle pellicole e delle carte sensibili per fotografia). Nel linguaggio comune, si utilizza lo stesso termine (in maniera impropria) per indicare lo ione ioduro (I-), il radicale ioduro (I•), o il gruppo funzionale ioduro (I-). Negli ioduri l'atomo di iodio presenta numero di ossidazione -1. Lo ioduro è un componente del sale iodato, imposto da molti governi per evitare la carenza di iodio, che ogni anno colpisce circa due miliardi di persone causando disabilità intellettive. Leggi (I-), l’unità di misura ufficialmente adottata attualmente si basa sulla conduttività elettrica che considera l’insieme dei saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi presenti in soluzione.
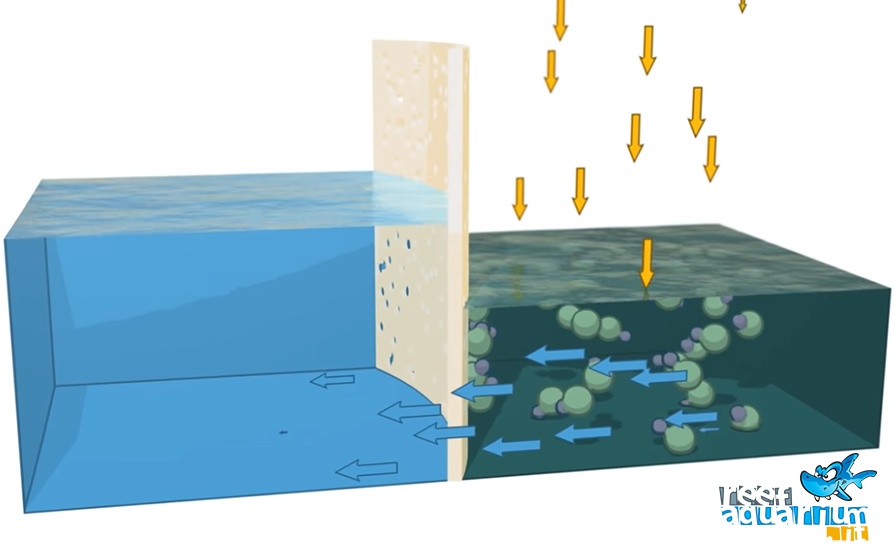
Per l’acquariofilo marino è pertanto fondamentale conoscere il contenuto salino dei reefLa barriera corallina è una formazione tipica dei mari e oceani tropicali, composta da formazioni rocciose sottomarine biogeniche costituite e accresciute dalla sedimentazione degli scheletri calcarei dei coralli, animali polipoidi facenti parte della classe antozoa, phylum Cnidaria. Questo tipo di ambiente è unico in quanto le barriere hanno creato delle isole e delle lagune in mari profondi, modificando sia il fondo sia le coste (ricoperte di sabbia finissima, frutto dell'erosione marina sui coralli e dell'azione di alcuni pesci che si cibano dei polipi). La barriera corallina fa parte di una piattaforma carbonatica, e generalmente ne costituisce la fascia marginale verso mare. Verso terra è spesso (ma non necessariamente) separata dalla costa da lagune poco profonde. Leggi dai quali provengono gli animali allevati al fine di adeguare correttamente la salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi nelle propria vasca.
Tuttavia, sfruttando le grandi capacità di adattamento degli organismi dei reefLa barriera corallina è una formazione tipica dei mari e oceani tropicali, composta da formazioni rocciose sottomarine biogeniche costituite e accresciute dalla sedimentazione degli scheletri calcarei dei coralli, animali polipoidi facenti parte della classe antozoa, phylum Cnidaria. Questo tipo di ambiente è unico in quanto le barriere hanno creato delle isole e delle lagune in mari profondi, modificando sia il fondo sia le coste (ricoperte di sabbia finissima, frutto dell'erosione marina sui coralli e dell'azione di alcuni pesci che si cibano dei polipi). La barriera corallina fa parte di una piattaforma carbonatica, e generalmente ne costituisce la fascia marginale verso mare. Verso terra è spesso (ma non necessariamente) separata dalla costa da lagune poco profonde. Leggi corallini, è possibile attraverso lente procedure di acclimatazione far coesistere animali provenienti da aree diverse mantenendo un contenuto salino compreso tra il 34 e il 36 ‰.
La composizione dell’acqua di mareIl mare è una vasta distesa di acqua salata, idrograficamente connessa con un oceano, che lambisce le coste di isole e terre continentali. Lo stesso termine certe volte è usato per indicare laghi, normalmente salati o molto voluminosi, che non hanno sbocchi sull'oceano come ad esempio il Mar Caspio, il Mar Morto ed il Mar di Galilea. Il termine mare è usato anche come sinonimo di oceano quando esprime un concetto generico, per esempio quando si parla dei mari tropicali o dell'acqua marina riferendosi, invece, a quella oceanica in generale. Leggi
La concentrazione di saleIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi varia a seconda dell’apporto dei fiumi e dell’intensità di evaporazione; poiché solo l’acqua pura evapora, i saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi rimangono sul fondo. Dunque maggiore sarà l’affluenza di fiumi nel mareIl mare è una vasta distesa di acqua salata, idrograficamente connessa con un oceano, che lambisce le coste di isole e terre continentali. Lo stesso termine certe volte è usato per indicare laghi, normalmente salati o molto voluminosi, che non hanno sbocchi sull'oceano come ad esempio il Mar Caspio, il Mar Morto ed il Mar di Galilea. Il termine mare è usato anche come sinonimo di oceano quando esprime un concetto generico, per esempio quando si parla dei mari tropicali o dell'acqua marina riferendosi, invece, a quella oceanica in generale. Leggi, minore sarà la concentrazione di saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi perché la mescolanza delle acque disperderà i saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi.
La proporzione dei saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi, invece, rimane sempre uguale: in tutte le distese di acqua salata il più presente è il cloruroLo ione cloruro (formula chimica Cl−) è lo ione di cloro con numero di ossidazione −1, cioè un atomo di cloro carico negativamente con un elettrone. Esso si forma normalmente sciogliendo acido cloridrico in acqua. I sali che contengono uno ione di questo tipo vengono detti cloruri. Ha una massa molecolare pari a circa 35,453 u ed è registrato col numero CAS 16887-00-6[4]. Leggi di sodio (NaCl), più comunemente conosciuto come “saleIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi da cucina”, presente tra il 70% e l’80% rispetto al totale dei saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi disciolti.
Altri elementi molto presenti come saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi disciolti in forma ionica, sono calcio, magnesio e carbonati, zolfo e potassio. Nelle acque marine sono altresì presenti nitrati e fosfati, che risalgono in superficie grazie alle correnti e favoriscono lo sviluppo degli organismi autotrofi (algheLe alghe (dal latino Algae) afferiscono ad un raggruppamento, non appartenente ad un taxon sistematico, rappresentato da organismi di struttura vegetale, autotrofi, unicellulari o pluricellulari, che producono energia chimica per fotosintesi, generando ossigeno e che non presentano una differenziazione in tessuti veri e propri. Nel corso del tempo, e nell'evoluzione della sistematizzazione scientifica dei viventi, all'interno di questo raggruppamento si sono venuti a trovare differenti gruppi sistematici aventi caratteristiche congruenti come la struttura molto semplice e non differenziata in tessuti e molto spesso la capacità fotosintetica. Le sole alghe verdi o clorofite, insieme alle embriofite, o piante terrestri, costituiscono il clade delle piante verdi, o viridiplantae. Leggi).
Oltre ai saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi, ai nitrati e fosfati, nell’acqua marina è possibile individuare gas disciolti, in prevalenza ossigeno e anidride carbonica. Nello specifico, l’ossigeno e l’anidride carbonica consentono i due processi fondamentali della vita marina: la respirazione e la fotosintesi clorofilliana. L’ossigeno disciolto nell’acqua di mareIl mare è una vasta distesa di acqua salata, idrograficamente connessa con un oceano, che lambisce le coste di isole e terre continentali. Lo stesso termine certe volte è usato per indicare laghi, normalmente salati o molto voluminosi, che non hanno sbocchi sull'oceano come ad esempio il Mar Caspio, il Mar Morto ed il Mar di Galilea. Il termine mare è usato anche come sinonimo di oceano quando esprime un concetto generico, per esempio quando si parla dei mari tropicali o dell'acqua marina riferendosi, invece, a quella oceanica in generale. Leggi è presente a tutte le profondità, compresa la zona afoticaLa zona afotica è una porzione di un oceano (o di un lago) non esposta alla luce solare per via della profondità dell'acqua che non permette la penetrazione della radiazione luminosa. In questa zona non si incontra altra luce se non quella prodotta tramite bioluminescenza. Leggi, grazie alle correnti marine. Infatti in assenza di correnti esso stazionerebbe solo nei venti metri più superficiali. Tuttavia in alcuni mari relativamente “chiusi” e poco soggetti a maree, come il Mar Nero, l’ossigeno è assente in profondità.
In piccole percentuali sono disciolti in mareIl mare è una vasta distesa di acqua salata, idrograficamente connessa con un oceano, che lambisce le coste di isole e terre continentali. Lo stesso termine certe volte è usato per indicare laghi, normalmente salati o molto voluminosi, che non hanno sbocchi sull'oceano come ad esempio il Mar Caspio, il Mar Morto ed il Mar di Galilea. Il termine mare è usato anche come sinonimo di oceano quando esprime un concetto generico, per esempio quando si parla dei mari tropicali o dell'acqua marina riferendosi, invece, a quella oceanica in generale. Leggi molti altri elementi chiamati oligoelementi tra cui stronzio, boro, silicio, fluoro e iodio.
Infine l’acqua di mareIl mare è una vasta distesa di acqua salata, idrograficamente connessa con un oceano, che lambisce le coste di isole e terre continentali. Lo stesso termine certe volte è usato per indicare laghi, normalmente salati o molto voluminosi, che non hanno sbocchi sull'oceano come ad esempio il Mar Caspio, il Mar Morto ed il Mar di Galilea. Il termine mare è usato anche come sinonimo di oceano quando esprime un concetto generico, per esempio quando si parla dei mari tropicali o dell'acqua marina riferendosi, invece, a quella oceanica in generale. Leggi contiene la “vita” sotto forma di organismi pelagici (plancton) e una percentuale di materia organica di scarto o in decomposizione (DOM – Materiale Organico Disciolto).
La salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi, la clorinitàLa clorinità è una grandezza che esprime il contenuto totale degli alogenuri cloruro (Cl-), bromuro (Br-) e ioduro (I-) all'interno di un corpo idrico. Leggi e la densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi
Il contenuto salino dell’acqua marina è misurabile direttamente solo attraverso procedimenti complessi che tuttavia possono essere sensibilmente disturbati dalla complessa composizione dei saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi.
E’ pertanto possibile rilevarla con buona approssimazione attraverso procedimenti indiretti come la determinazione della clorinitàLa clorinità è una grandezza che esprime il contenuto totale degli alogenuri cloruro (Cl-), bromuro (Br-) e ioduro (I-) all'interno di un corpo idrico. Leggi, considerato che la quantità di cloruroLo ione cloruro (formula chimica Cl−) è lo ione di cloro con numero di ossidazione −1, cioè un atomo di cloro carico negativamente con un elettrone. Esso si forma normalmente sciogliendo acido cloridrico in acqua. I sali che contengono uno ione di questo tipo vengono detti cloruri. Ha una massa molecolare pari a circa 35,453 u ed è registrato col numero CAS 16887-00-6[4]. Leggi nell’acqua marina è direttamente proporzionale alla salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi. Per questo rapporto vale una semplice relazione matematica (Spotte, 1979):
SalinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi (in g/Kg di acqua marina) = 1,80655 x concentrazione di cloruroLo ione cloruro (formula chimica Cl−) è lo ione di cloro con numero di ossidazione −1, cioè un atomo di cloro carico negativamente con un elettrone. Esso si forma normalmente sciogliendo acido cloridrico in acqua. I sali che contengono uno ione di questo tipo vengono detti cloruri. Ha una massa molecolare pari a circa 35,453 u ed è registrato col numero CAS 16887-00-6[4]. Leggi (in g/Kg di acqua marina).
Determinare la quantità di cloruroLo ione cloruro (formula chimica Cl−) è lo ione di cloro con numero di ossidazione −1, cioè un atomo di cloro carico negativamente con un elettrone. Esso si forma normalmente sciogliendo acido cloridrico in acqua. I sali che contengono uno ione di questo tipo vengono detti cloruri. Ha una massa molecolare pari a circa 35,453 u ed è registrato col numero CAS 16887-00-6[4]. Leggi è comunque un procedimento ottenibile in laboratorio attraverso un processo di titolazione utilizzando una soluzione di nitrato d’argento.
Anche tale misurazione è comunque frutto di un procedimento complesso e realisticamente non applicabile in ambito acquariofilo.
Un parametro che consente comunque di monitorare il contenuto salino dell’acqua, misurabile anche in ambito di acquariofilia domestica, è la densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi. La densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi è una grandezza fisica e, nello specifico caso dell’acqua marina, viene definita come massa (in grammi) per 1 cm3 (o millilitri) di acqua marina.
Coerentemente a quanto fino ad ora affermato, la salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi in un acquario di barriera dovrebbe attestarsi tra il 34 e il 36 ‰. Questa corrisponde ad una densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi tra 1,0228 e 1,0242 g/ml (ad una temperatura di 25 °C).
E’ tuttavia doveroso tenere sempre presente l’esistenza di una correlazione tra la densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi e la temperatura, dovuta all’incremento volumetrico del liquido all’aumentare del valore termico. Ad esempio la densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi di 1,0239 a 20 °C (salinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi = 34 ‰) corrisponde a 1,0228 a 30 °C. La maggior parte delle sostanze naturali tendono ad espandersi con il riscaldamento, riducendo così la densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi. Nel caso dell’acqua ciò accade in particolari condizioni e modalità, poiché si verifica un fenomeno definito “densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi anomala” che vede l’acqua espandersi a temperature superiori e inferiori a 4 °C. Esattamente a 4 °C l’acqua presenta la maggiore densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi.
Il grafico mostra la SalinitàLa salinità indica la concentrazione di sali di una soluzione. Mentre in passato la salinità era determinata sulla base della clorinità, grandezza che esprime il contenuto totale di cloruri (Cl-), bromuri (Br-) e ioduri (I-), attualmente l'unità di misura ufficialmente adottata si basa sulla conduttività elettrica e quindi tiene maggiormente conto di tutto l'insieme dei sali presenti in soluzione. Leggi e i corrispondenti valori della DensitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi a 25°C
|
SALINITÀ’ (PSU)
|
DENSITÀLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi a 25°C
|
|
0
|
997.05 |
|
29
|
1018.8 |
|
30
|
1019.6 |
|
31
|
1020.3 |
|
32
|
1021.1 |
|
33
|
1021.8 |
|
34
|
1022.6 |
|
35
|
1023.3 |
|
36
|
1024.1 |
|
37
|
1024.9 |
|
38
|
1025.6 |
|
39
|
1026.4 |
Si consideri che questa particolare caratteristica rende possibile la vita negli habitat di acqua dolce anche in condizioni di freddo estremo. Nel periodo invernale infatti, a causa della densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi più elevata, l’acqua fredda a 4 °C scende sul fondo dei bacini dove, al contrario delle acque superficiali, non gela. In questo modo i pesciCon il termine pesci, dal latino pisces, si intende un gruppo eterogeneo di organismi vertebrati fondamentalmente acquatici, coperti di scaglie e dotati di pinne, che respirano attraverso le branchie. Con oltre 32 000 specie coprono quasi il 50% del totale delle specie del subphylum vertebrata. Leggi e altri organismi riescono a sopravvivere anche agli inverni più rigidi sul fondo di acque sufficientemente profonde.
Oltre alle proprietà dell’acqua (capacità termica, tensione superficiale, capacità solventeimbizione, capillarità, ecc.), l’acqua salata ha un’ulteriore caratteristica: il saleIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi disciolto causa l’abbassamento del punto di fusione (abbassamento crioscopico) dell’acqua di circa 2 °C, permettendo ad alcune specie di pesciCon il termine pesci, dal latino pisces, si intende un gruppo eterogeneo di organismi vertebrati fondamentalmente acquatici, coperti di scaglie e dotati di pinne, che respirano attraverso le branchie. Con oltre 32 000 specie coprono quasi il 50% del totale delle specie del subphylum vertebrata. Leggi di vivere a temperature prossime agli 0 °C. A causa dei saliIn chimica, un sale è un composto chimico elettricamente neutro costituito dall'insieme di più ioni (anioni e cationi), in genere disposti all'interno di un reticolo cristallino, uniti da un legame ionico di ionicità più o meno elevata. I sali hanno diverso grado di solubilità nei diversi solventi. In una soluzione salina si osserva un fenomeno detto innalzamento ebullioscopico (innalzamento del punto di ebollizione) e di abbassamento crioscopico (abbassamento del punto di congelamento) rispetto al solvente puro. Leggi disciolti ha una densitàLa densità di una sostanza è il rapporto tra la massa e il volume di tale sostanza. Nel Sistema Internazionale la densità si misura in kg/m³; nel sistema CGS in g/cm³ o equivalentemente in g/mL. Nell'uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Nei fluidi i corpi con densità minore galleggiano su quelli a densità maggiore, se sottoposti a un campo gravitazionale. Questa proprietà è alla base del principio di Archimede. Leggi maggiore (circa 1,03 kg/dm³) rispetto all’acqua dolce e per questo gli oggetti immersi in essa, ricevendo una spinta idrostatica maggiore, galleggiano meglio.
Bibliografia
- Fish and Invertebrate Culture: Water Management in Closed Systems, 2nd edition by Stephen Spotte. New York: John Wiley and Sons. SPOTTE, S. H. 1979
- (EN) Thermophysical properties of seawater, su mit.edu, Massachusetts Institute of Technology, 8 luglio 2016.
- (EN) International oceanographic tables, su unesco.org, Organizzazione delle Nazioni Unite per l’educazione, la scienza e la cultura, 1987.
- (EN) Physical properties of sea water, su kayelaby.npl.co.uk, National Physical Laboratory.